|
疼痛调节的分子机制:离子通道改变
在外周神经末梢感知疼痛的受体有多种离子通道,它们能够检测外部刺激、编码信号并诱导膜兴奋。通过调节离子跨膜电流,离子通道产生电信号。电压敏感通道的激活以顺序方式发生。就导致通道激活的因素而言,它们可分为两大类:电压调节的离子通道和特定分子结合调节的离子通道。当有害刺激导致伤害性感觉神经元的 A-δ(Aδ)纤维和 A-β(Aβ)纤维以及无髓鞘 C 纤维去极化时,疼痛感觉被转导。这种去极化通过激活位于末梢的电压门控离子通道和膜蛋白发生,导致这些刺激在神经元内转化为电信号。 Part1、电压门控钠通道(VGSC) Part2、电压依赖性钙通道(VGCCs) Part3、感应器电位通道(TRP) Part4、K + 通道 Part5、酸敏感离子通道(ASICs)和氯离子通道 Part6、机械门控阳离子通道 Part7、嘌呤能通道 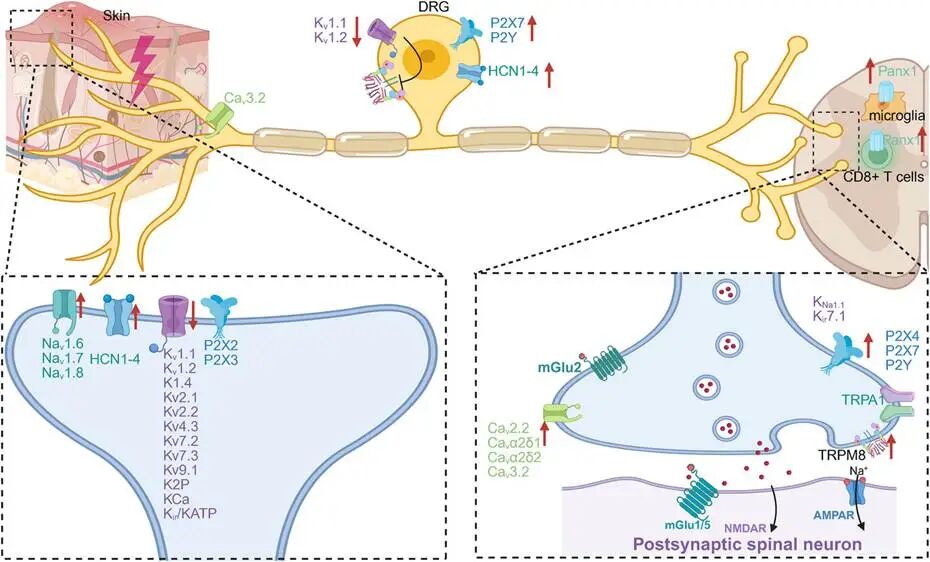
Part1、电压门控钠通道(VGSC)
电压门控钠通道(VGSC)家族由九个成员组成,即 Nav1.1 ~ Nav1.9。 当细胞膜去极化时,VGSC 会迅速转变为开放构象,使钠离子(Na + )逆浓度梯度进入细胞。触发动作电位并产生神经末梢的痛觉信号。躯体末梢受 Nav1.7、Nav1.8 和Nav1.9 的影响,而内脏末梢则受 Nav1.1、Nav1.6和 Nav1.9 影响。Nav1.7 和 Nav1.8,在背根神经节(DRG)感觉神经元中具有优先表达,在外周疼痛信号传导中发挥重要作用。 炎症介质刺激痛觉感受器活动增强,这种增强依赖于 Na V 1.7,导致 Na V 1.7的电流和表面表达增加,这是通过增强囊泡装载、正向转运以及 Na V 1.7整合到远端轴膜中实现的。功能获得性 Nav1.7 突变会导致剧烈疼痛,而功能丧失性突变个体则表现出对疼痛极度不敏感的综合征。Nav1.7 的抑制也在骨关节炎大鼠模型中显示出镇痛效果。近期临床试验也表明,选择性阻断Nav1.8 可以减轻慢性术后疼痛(CPPP),为靶向外周Nav1.8 通道能有效减少人类疼痛信号提供了证据。抑制 DRG 神经元中的 Nav1.8 也可能缓解骨关节炎疼痛。此外,结肠中促炎细胞因子的水平升高可以通过增强Na V 1.8 并抑制电压门控钾(K + )电流(如 IA 和 IK)来激活和敏化 DRG 神经元,从而增强活动性溃疡性结肠炎患者的神经元兴奋性。 Part2、电压依赖性钙通道(VGCCs)
电压门控钙通道(VGCCs)由五个亚基组成,分别是α1、α2、β、δ和γ。根据其药理学特性,VGCCs 可分为不同类型,如 T 型、N
|