|
关于质子梯度驱动ATP合成的机制,米切尔本人并未做出合理的解释。随着人们对线粒体结构和功能深入研究,1961年首次从线粒体中分离出一种能合成ATP的酶复合物并命名为ATP合酶。1973年,英国科学家约翰·沃克(John E. Walker)利用X射线晶体技术,对ATP合酶的部分结构进行了详细解析,为理解ATP合酶的结构及催化机制提供了重要线索。 现已清楚,ATP合酶由F₁和F₀两个主要部分组成,故亦称F₁F₀-ATP合酶,位于线粒体内膜,负责利用跨膜质子梯度的能量来合成ATP,是细胞能量代谢的核心分子。 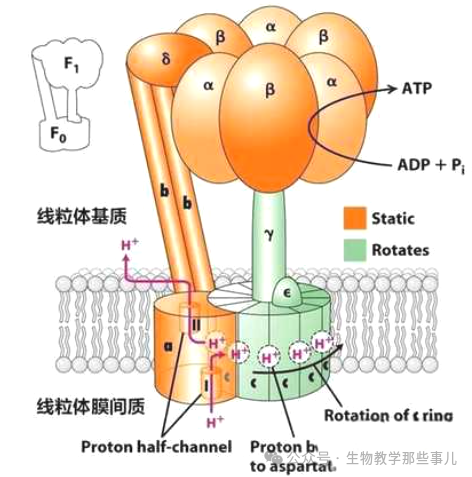
F₁部分位于线粒体基质,是一个水溶性复合体。由α、β、γ、δ、ε5种不同的亚基组成,其中,α和β亚基各含有3个拷贝,形成一个六聚体(α₃β₃),γ、δ和ε亚基各1个。F₁部分是ATP合成的催化部位,负责催化ADP和无机磷酸Pi合成ATP。 F₀部分嵌入在线粒体内膜中,是一个膜结合复合体。由a、b、c3种不同的亚基组成,其中,c亚基形成一个环状结构,通常含有多个拷贝(哺乳动物中通常有10-14个c亚基)。F₀部分是一个质子通道,负责将质子从膜间隙泵回基质。 结合约翰·沃克的结构研究和自身的发现,1979年,美国科学家博耶Paul D. Boyer提出“旋转催化机制”来解释F₁F₀-ATP合酶如何利用跨膜质子梯度的能量合成ATP。他将ATP合酶比作一个可以旋转的微型分子马达,他发现ATP合酶的F1部分由多个亚基组成,其中β亚基的是真正的催化位点。在ATP形成过程中这些催化位点会经历三种不同的构象状态:松弛态L(Loose)、 紧密态T(Tight)及开放态O(Open)。其中松弛状态下ADP与Pi进行结合,紧密状态时压缩合成产物ATP,开放状态下完成产物ATP的释放。 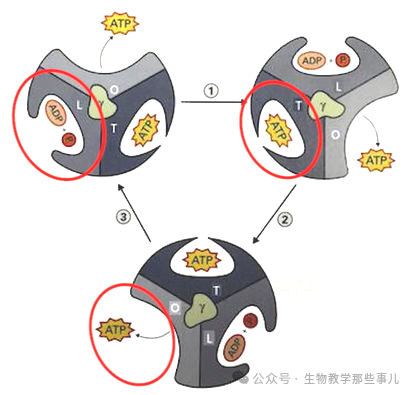
β亚基的三种构象变化是由于γ亚基的旋转导致的,当质子流从膜间隙通过F₀时,巨大的能量驱动c亚基环旋转,进而带动γ亚基转动,最终诱导β亚基构象变化,将ATP合成并释放。 与化学渗透学说一样,旋转催化机制也一度被认为是异想天开,然而其逐渐得到了多方面的实验证据支持,包括X射线晶体研究、荧光技术等。尤其是1994年,约翰·沃克再一次通过高分辨率的晶体结构解析,进一步确立了ATP合酶的结构,为旋转催化机制提供了直接的结构证据。
|